Flusseinträge unter globalem Wandel –
Erforschung des Schicksals der Amazonas Flussfahne
08.04.2021 – Warum ist das Erforschen von Süßwassereinträgen ins Meer so wichtig?
Quarantäne-Tag 8 von 10 Tagen (fast geschafft!!), die wir absolvieren müssen, bevor wir gen Las Palmas, Gran Canaria starten können. Während wir in unseren Hotelzimmern darauf warten, dass es so richtig losgeht, steigt unsere Vorfreude mehr und mehr. Wir können es kaum noch erwarten, endlich die Gangway des F/S Meteor zu betreten! In diesem Eintrag möchten wir euch unser Studiengebiet ein wenig näher vorstellen - erfahrt hier, warum der Amazonas für uns so faszinierend ist.
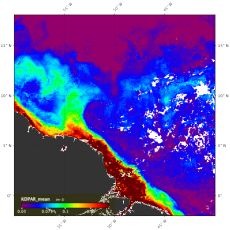
Der Amazonas Regenwald wird oft als die "Lunge der Erde" bezeichnet, da er eine Schlüsselrolle im globalen Kohlenstoffkreislauf spielt und zu etwa 15% der globalen Photosynthese1 beiträgt: durch das "Atmen" nehmen die Bäume CO2 auf und wandeln es in organisches Material wie Blätter, Humus und Holz um2. Das Einzugsgebiet des Amazonas erfährt eine enorme Niederschlagsmenge von ~2000 mm pro Jahr3. In Kombination mit der hohen Luftfeuchtigkeit der Region speist dieser Niederschlag den Amazonas4,5, der zu fast 20 % des globalen Süßwassereintrags in die Ozeane beiträgt5. Die gewaltige Wasserlast des Amazonas transportiert große Mengen von organischem Material und Nährstoffen mit sich, die vom Wald produziert werden und reichert den westlichen tropischen Nordatlantik (WTNA) an6,7.
Da das Wachstum von Phytoplankton durch die Verfügbarkeit von Nährstoffen begrenzt wird, steigert das Flusswasser die Primärproduktion im WTNA und erhöht dadurch die Menge an CO2, die während der Photosynthese aufgenommen wird. Dort, wo sich das Wasser der Flussfahne mit dem Wasser des WTNA vermischt (mesohaline Region der Flussfahne), dominieren die Nährstoffe Silikat und Phosphat, während Nitrat und Nitrit (Stickstoffquellen) nur in geringen Konzentrationen vorhanden sind8. Daher ist das Wachstum von “gewöhnlichem” Phytoplankton, das Stickstoff aus dem Wasser zum Wachsen benötigt, stark begrenzt.
Einige Phytoplanktonarten (Diazotrophe oder auch Stickstofffixierer) sind jedoch in der Lage, Stickstoff aus einer anderen Quelle als dem umgebenden Wasser zu nutzen: Di-Stickstoff (N2), der aus der Atmosphäre stammt und sich kontinuierlich im Meerwasser löst, für andere Phytoplanktonarten aber nicht zugänglich ist. Daher spielen Stickstofffixierer eine Schlüsselrolle für die Primärproduktion im WTNA, da sie von dem Silikat und Phosphat profitieren, das vom Amazonas geliefert wird, aber nicht auf den Eintrag von Stickstoff angewiesen sind. Wie das im Detail funktioniert, erklären wir euch in einem späteren Blog-Beitrag. Alleine sind die Stickstofffixierer allerdings nicht für die Aufnahme der gewaltigen Mengen an CO2 verantwortlich. Sie “düngen” jedoch den Rest der Phytoplanktongemeinschaft in der Flussfahne, da sie aktiv einen Teil des Stickstoffs, den sie fixieren, in Formen freisetzen, die anderen Phytoplanktonarten dann zur Verfügung stehen. Auch durch Absterben der Diazotrophen entsteht durch bakterielle Abbauprozesse weiterer Stickstoff, der für die gesamte Phytoplanktongemeinschaft nutzbar ist.
Diese spezifischen Bedingungen in der Flussfahne führen zu einer interessanten Symbiose zwischen einer Mikroalge bzw. einer Phytoplankton-Gruppe (den Kieselalgen oder Diatomeen) und einem Bakterium, das in der Lage ist, atmosphärischen Stickstoff zu fixieren (Diazotrophe)9. Die Kieselalge ernährt sich vom Silikat und Phosphat der Flussfahne, während sie ihren Stickstoff von den Diazotrophen erhält, mit denen sie vergesellschaftet ist. Häufig beobachtete Blüten von Diatomeen-Diazotrophen-Assoziationen (DDAs) in der Amazonas-Flussfahne können direkt oder durch die Düngung anderer Phytoplanktonarten mit biologisch verfügbarem Stickstoff eine gewaltige Aufnahme von CO2 bewirken9-12.
Die physikalischen und biogeochemischen Eigenschaften des Amazonas prägen die Struktur der Phytoplankton-Gemeinschaft im WTNA6,8,13,14 und verstärken oder schwächen die CO2-Senke, die durch die Vermischung zwischen der Amazonas-Flussfahne und dem Ozean entsteht12,15,16.
Menschliche Eingriffe verändern das Gesicht Amazoniens und haben Auswirkungen auf die globale Kohlenstoffbilanz17 und den hydrologischen Kreislauf18. Durch Abholzung des Regenwalds wird der in den Bäumen gespeicherte Kohlenstoff wieder in die Atmosphäre freigesetzt und dominiert das biotische atmosphärische CO219, wodurch die CO2-Speicherkapazität (biologische Kohlenstoffpumpe) des Waldes um 40 % sinkt20, was zur globalen Erwärmung beiträgt21. Die Entwaldung hat bereits den Wasserhaushalt in Amazonien beeinflusst18,22,23. Mehrere Klimaszenarien sagten eine Störung der natürlichen El Niño Southern Oscillation (ENSO) voraus, einem Klimaphänomen, das zu einem häufigeren und schwereren Auftreten von ENSO-bedingten Dürren24 und Überschwemmungen führt14,18,25. Anhaltende Dürre könnte zu einer massiven Verringerung des globalen Flusseintrags in die Meere führen26. Veränderungen im Amazonasgebiet könnten wirklich weitreichende Folgen haben, darunter kühlere und trockenere Winter in Nordeuropa und Ostkanada und wärmere und feuchtere in Südeuropa und dem Osten der USA. Die Erwärmung über der Arktis würde zu einer Verringerung der lokalen Meereisausdehnung und einem verstärkten Abfluss durch Flüsse in den hohen Breitengraden führen27. Die Veränderungen der physikalischen und biogeochemischen Eigenschaften der Flussfahne des Amazonas13,14, die auf diese Veränderungen folgen könnten, sind noch nicht ausreichend erforscht.
Die global wichtigsten Kohlenstoffsenken wurden in stickstofflimitierten Zonen entdeckt. Das Verständnis der biologischen Kohlenstoffpumpe der Amazonas-Flussfahne ist daher von großer Bedeutung. Um die Zukunft des Planeten Erde zuverlässig einschätzen zu können, ist es wichtig, die Nutzung und Umwandlung von Stickstoff in komplexen Systemen wie der Amazons-Flussfahne besser zu verstehen. Das ist das Ziel des von der Deutschen Forschungsgemeinschaft (DFG) geförderten MeNARP-Projekts (“Metabolism of Nitrogen in the ARP and Tropical North Atlantic”). Neben dem Einfluss des vom Amazonas gelieferten Stickstoffs auf den Stickstoff- und Kohlenstoffkreislauf an sich werden wir auch dessen Auswirkungen auf höhere trophische Ebenen (z.B. Zooplankton) untersuchen.
Das war es von uns für heute, wir hoffen, ihr konntet etwas für euch mitnehmen. Im nächsten Eintrag werden wir ein wenig über unsere privaten Quarantäne-Erfahrungen und unsere "Reise vor der Reise" berichten. Bleibt gespannt und kommt mit uns auf große Fahrt!
Text: Choisnard N., Umbricht J., Voss M. (alle IOW)
| Expedition: | M174 |
| Mission: | MeNARP |
| Start: | 12.04.2021 - Las Palmas |
| Ziel: | 31.05.2021 - Emden |
Quellen:
- Field, C. B., Behrenfeld, M. J., Randerson, J. T. & Falkowski, P. Primary Production of the Biosphere: Integrating Terrestrial and Oceanic Components. Science 281, 237–240 (1998).
- Raich, J. W. & Potter, C. S. Global patterns of carbon dioxide emissions from soils. Global Biogeochemical Cycles 9, 23–36 (1995).
- Henderson, A. The palms of the Amazon. The palms of the Amazon. (1995).
- Recycling of water in the Amazon Basin: An isotopic study - Salati - 1979 - Water Resources Research - Wiley Online Library. https://agupubs.onlinelibrary.wiley.com/doi/epdf/10.1029/WR015i005p01250.
- Dai, A. & Trenberth, K. E. Estimates of Freshwater Discharge from Continents: Latitudinal and Seasonal Variations. JOURNAL OF HYDROMETEOROLOGY 3, 28 (2002).
- Smith, W. O. & Demaster, D. J. Phytoplankton biomass and productivity in the Amazon River plume: correlation with seasonal river discharge. Continental Shelf Research 16, 291–319 (1996).
- Körtzinger, A. A significant CO2 sink in the tropical Atlantic Ocean associated with the Amazon River plume. Geophysical Research Letters 30, (2003).
- Goes, J. I. et al. Influence of the Amazon River discharge on the biogeography of phytoplankton communities in the western tropical north Atlantic. Progress in Oceanography 120, 29–40 (2014).
- Subramaniam, A. et al. Amazon River enhances diazotrophy and carbon sequestration in the tropical North Atlantic Ocean. Proceedings of the National Academy of Sciences 105, 10460–10465 (2008).
- Capone, D. G., Zehr, J. P., Paerl, H. W., Bergman, B. & Carpenter, E. J. Trichodesmium, a Globally Significant Marine Cyanobacterium. Science 276, 1221–1229 (1997).
- Carpenter, E. J. et al. Extensive bloom of a N2-fixing diatom/cyanobacterial association in the tropical Atlantic Ocean. Marine Ecology Progress Series 185, 273–283 (1999).
- Cooley, S. R. & Yager, P. L. Physical and biological contributions to the western tropical North Atlantic Ocean carbon sink formed by the Amazon River plume. Journal of Geophysical Research: Oceans 111, (2006).
- Coles, V. J. et al. The pathways and properties of the Amazon River Plume in the tropical North Atlantic Ocean: AMAZON RIVER PLUME. J. Geophys. Res. Oceans 118, 6894–6913 (2013).
- Gouveia, N. A., Gherardi, D. F. M. & Aragão, L. E. O. C. The Role of the Amazon River Plume on the Intensification of the Hydrological Cycle. Geophys. Res. Lett. 46, 12221–12229 (2019).
- del Giorgio, P. A., Cole, J. J. & Cimbleris, A. Respiration rates in bacteria exceed phytoplankton production in unproductive aquatic systems. Nature 385, 148–151 (1997).
- le B. Williams, P. J. The balance of plankton respiration and photosynthesis in the open oceans. Nature 394, 55–57 (1998).
- Andreae, M. O. et al. Biogeochemical cycling of carbon, water, energy, trace gases, and aerosols in Amazonia: The LBA-EUSTACH experiments. Journal of Geophysical Research: Atmospheres 107, LBA 33-1-LBA 33-25 (2002).
- Liang, Y.-C. et al. Amplified seasonal cycle in hydroclimate over the Amazon river basin and its plume region. Nature Communications 11, 4390 (2020).
- Woodwell, G. M. et al. Global Deforestation: Contribution to Atmospheric Carbon Dioxide. Science 222, 1081–1086 (1983).
- Berenguer, E. et al. A large-scale field assessment of carbon stocks in human-modified tropical forests. Global Change Biology 20, 3713–3726 (2014).
- Booth, B. B. B. et al. High sensitivity of future global warming to land carbon cycle processes. Environ. Res. Lett. 7, 024002 (2012).
- Khanna, J., Medvigy, D., Fueglistaler, S. & Walko, R. Regional dry-season climate changes due to three decades of Amazonian deforestation. Nature Climate Change 7, 200–204 (2017).
- Gloor, M. et al. Intensification of the Amazon hydrological cycle over the last two decades. Geophysical Research Letters 40, 1729–1733 (2013).
- Timmermann, A. et al. Increased El Niño frequency in a climate model forced by future greenhouse warming. Nature 398, 694–697 (1999).
- Duffy, P. B., Brando, P., Asner, G. P. & Field, C. B. Projections of future meteorological drought and wet periods in the Amazon. PNAS 112, 13172–13177 (2015).
- Malhi, Y. et al. Climate Change, Deforestation, and the Fate of the Amazon. Science 319, 169–172 (2008).
- Jahfer, S., Vinayachandran, P. N. & Nanjundiah, R. S. Long-term impact of Amazon river runoff on northern hemispheric climate. Scientific Reports 7, 10989 (2017).