Phytoplanktonentwicklung an der Küstenstation "Seebrücke Heiligendamm" im Jahre 2012
Die Sektionen Biologische Meereskunde und Meereschemie des Leibniz-Instituts für Ostseeforschung Warnemünde (IOW) führen wöchentliche Probennahmen an der Seebrücke Heiligendamm (54°08,55' N; 11°50,60' E) durch. In diesem Bericht werden die Ergebnisse der Phytoplankton-Untersuchungen vorgestellt. Es wurde Oberflächenwasser mit einer Pütz entnommen.
Die Phytoplanktonbiomasse wurde durch mikroskopische Zählung (UTERMÖHL-Methode) und die Chlorophyll-a-Konzentration durch Ethanol-Extraktion und fluorometrische Messung bestimmt. Dabei wurden die Methodenvorschriften von HELCOM zugrundegelegt (http://www.helcom.fi/groups/monas/CombineManual/AnnexesC/en_GB/). Die Zählung der Phytoplankton-Proben erfolgte mit dem Zählprogramm OrgaCount und basiert auf der HELCOM-Artenliste, die jährlich aktualisiert wird: http://www.ices.dk/env/repfor/index.asp (PEG_BVOL2012; Grundlagen siehe in Olenina et al. 2006). Die spezifischen analytischen Bedingungen der Chlorophyll-a-Bestimmung sind in Wasmund et al. (2006) dargelegt. Es werden hier entsprechend der Entscheidung der BLMP-Unter-Arbeitsgruppe Qualitätssicherung vom 11.9.2008 die Chlorophyll-a-Konzentrationen angegeben, die nicht für Phaeopigment korrigiert sind.
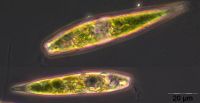
Am 24.07.2012 war die Probenahme ausgefallen wegen Bauarbeiten an der Seebrücke. Darüber hinaus konnten die Phytoplanktonproben einiger Messtage nicht mikroskopisch ausgewertet werden, da es sturmbedingt zu hohen Sedimentanteilen in den Proben gekommen war. Der Anteil solcher nicht auswertbarer Proben scheint mit den Jahren zuzunehmen, vielleicht weil die Station an der Seebrücke wegen Versandung immer flacher wird.
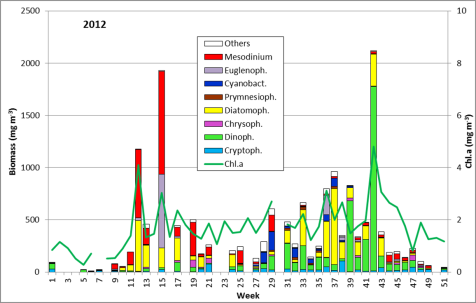
Die Ergebnisse sind in Abb. 1 dargestellt.
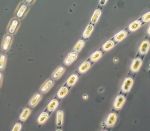
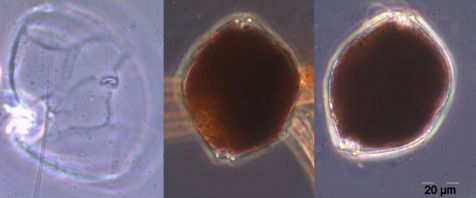
Trotz Lücken in der Auswertung der Phytoplanktonproben können wir behaupten, dass die Phytoplanktonbiomasse im Januar und Februar 2012 sehr gering war. Die Chlorophyll-a-Konzentrationen lagen meistens deutlich unter 1 mg m-3. Im Januar waren Ceratium tripos und Teleaulax sp. dominant. Im Februar entwickelte sich zunehmend Mesodinium rubrum, ab 6.3.2012 (Woche 10) auch Kieselalgen (Diatomophyceae). Mesodinium rubrum und Kieselalgen erreichten ein erstes Maximum zum 20.3.2012 (Woche 12). Wie im vergangenen Jahr, trat auch die Euglenophyceae Eutreptiella braarudii (Bild 1) auf.

Unter den Kieselalgen dominierten zur Zeit ihres Maximums Skeletonema sp. (Bild 2), Detonula confervacea (Bild 3), Chaetoceros spp. (insbesondere Ch. wighamii) und Rhizosolenia setigera, aber nicht mehr Achnanthes taeniata. Das Kieselalgenmaximum erschien zur selben Zeit wie im Vorjahr, war aber deutlich niedriger. Im Vergleich zum Vorjahr war Mesodinium rubrum viel stärker vertreten, aber Dictyocha speculum fast gar nicht.
Nach einem deutlichen Biomasserückgang erschien am 10.4.2012 (Woche 15) ein weiteres Maximum, das allerdings weniger von Kieselalgen (Skeletonema sp.) als viel mehr von dem Flagellaten Eutreptiella sp. geprägt war, der bereits in den Jahren 2008 und 2010 sehr bedeutsam war. Er verschwand aber schnell wieder. Obwohl die Proben unmittelbar vor und nach dem 10.4.2012 nicht auswertbar waren, zeigen die Chlorophyll-Werte, dass diese Blüte nur von kurzer Dauer war.
Insgesamt gesehen war die Frühjahrsblüte, insbesondere die Kieselalgenentwicklung, im Gegensatz zum Vorjahr schwach. Der sonst häufige Kieselflagellat Dictyocha speculum (in Abb. 1 zu den Chrysophyceen gerechnet) trat nur am 8.5. und 22.5.2012 (Woche 19 und 21) in geringen Abundanzen auf. Auch die häufig registrierte Ablösung der Kieselalgen durch Dinoflagellaten wurde im Jahre 2012 nicht festgestellt.

Ungewöhnlich ist das kurzzeitige Erscheinen der großen Kieselalge Coscinodiscus radiatus (Bild 4) mit 82 mg m-3 am 15.5.2012 (Woche 20). In den folgenden Wochen blieb die Biomasse relativ gering, aber die Diversität war recht hoch. Am 12.6.2012 (Woche 24) dominierte Melosira moniliformis (Bild 5) neben Dactyliosolen fragilissimus, Heterocapsa rotundata und Plagioselmis prolonga, und es begann die Entwicklung von Ceratium tripos. Am 19.6.2012 trat wiederum Mesodinium rubrum stark auf, daneben aber auch heterotrophe Ciliaten (Strombidium u.a.). An diesem Tag erschienen die stickstoff-fixierenden Cyanobakterien Anabaena spp.und Aphanizomenon sp., die neben den koloniebildenden Cyanobakterien, wie Aphanocapsa spp. und Snowella spp. dann bis in den Herbst präsent bleiben. Ab dem 10.7.2012 kam Nodularia spumigena (Bild 6) hinzu und entwickelten bis zum 17.7.2012 (Woche 29) schnell eine Biomasse von 134 mg m-3, verschwand vorübergehend wieder, erschien am 7.8.2012 mit 61 mg m-3 und blieb mit reduzierten Biomassen bis Ende September präsent.

Am 17.7.2012 sind neben Mesodinium rubrum noch Cladopyxis claytonii und Cymbomonas tetramitiformis erwähnenswert. Am 31.7.2012 (Woche 31) war der Dinoflagellat Alexandrium pseudogonyaulax (Bild 7) mit 137 mg/m³ noch bedeutsamer als bereits im Vorjahr.

In den folgenden Wochen bleibt Ceratium tripos wichtig, aber auch andere Dinoflagellaten (z.B. Prorocentrum micans) sowie die typischen Spätsommer-Kieselalgen, wie Proboscia alata, Cerataulina pelagica (Bild 8) und Dactyliosolen fragilissimus (Bild 9) entwickeln sich. Diese Kieselalgen nahmen zum Ende September (Woche 39) stark ab, während Ceratium-Arten (C. tripos, C. lineatum, C. fusus; vgl. Bild 10) stark anwuchsen. Das Maximum erreichten die Ceratium-Arten am 9.10.2012 (Woche 42), wobei allein Ceratium tripos 1120 mg m-3 ausmachte.
An diesem Tag sind auch Pseudo-nitzschia pungens, Guinardia flaccida, Prorocentrum micans, Protoperidinium divergens, Dinophysis norvegica, Chaetoceros affinis, Ditylum brightwellii und Mesodinium rubrum erwähnenswert.
Die im September 2011 beobachtete starke Blüte von Pseudosolenia calcar-avis wiederholte sich im Jahre 2012 nicht; diese Art wurde im Jahre 2010 erstmals von uns beobachtet. Auch die in manchen Jahren gefundene Blüte von Coscinodiscus granii trat nicht auf. Diese Art machte an ihrem Maximum an 23.10.2012 (Woche 43) nur 66 mg m-3 aus. Ab dem 30.10.2012 (Woche 44) sind die Biomassen sehr gering und von Ceratium tripos und Mesodinium rubrum, zeitweise auch von Dictyocha speculum dominiert.

Eine Verlängerung der Wachstumsperiode in den Winter hinein, wie sie im Jahre 2010 diskutiert wurde, konnte im Jahre 2012 also nicht nachgewiesen werden. Insgesamt war im Jahre 2012 die Kieselagenentwicklung schwach.
Literatur:
Olenina, I., Hajdu, S., Andersson, A.,Edler, L., Wasmund, N., Busch, S., Göbel, J., Gromisz, S., Huseby, S., Huttunen, M., Jaanus, A., Kokkonen, P., Ledaine, I., Niemkiewicz, E. (2006): Biovolumes and size-classes of phytoplankton in the Baltic Sea. Baltic Sea Environment Proceedings No.106, 144pp.
Internet-Zugang:
Paper: http://www.helcom.fi/stc/files/Publications/Proceedings/bsep106.pdf
Tabelle: http://www.helcom.fi/stc/files/Publications/Proceedings/bsep106ANNEX1Biovolumes_web.xls
Wasmund, N., Topp, I., Schories, D. (2006): Optimising the storage and extraction of chlorophyll samples. Oceanologia 48: 125-144.
IOW, 17.01.2013
Dr. Norbert Wasmund,
Susanne Busch,
Christian Burmeister,
Regina Hansen.
Leibniz Institute für Ostseeforschung Warnemünde (IOW),
Seestr. 15,
D-18119 Rostock-Warnemünde
Korrespondierender Autor: Dr. Norbert Wasmund

Der Zustand der Ostsee
- Jährliche Zustandseinschätzungen
- Fahrtberichte
- Daten der autonomen Messstationen
- Faktenblätter
- Kontinuierliche CO2- und O2-Messungen auf Frachtschiff FINNMAID
- Entwicklung der suboxischen und anoxischen Bereiche seit 1969
- Baltic Thalweg Transekte seit 2014
- Algenblüten vor Heiligendamm seit 1998
- Salzwassereinbruch Dezember 2014
- Salzwassereinbruch Januar 2003
- Barotrope Salzwassereinbrüche 1887 - 2018
- Weiterführende Literatur
IOW-Fotogalerie einzelliger Ostseealgen
... licht- und elektronenmikroskopische Aufnahmen pelagischer Mikroalgen