Aquatisches Monitoring mittels mikrobieller Nukleinsäuren
Die Herausforderung: Eines der drängendsten Menschheitsprobleme der heutigen Zeit ist der Verlust von Biodiversität und Ökosystemfunktionen in intensiv genutzten Ökosystemen. Einen dramatischen und zentralen Anteil an der Destabilisierung von Ökosystemen haben sogenannte anthropogene – also vom Menschen verursachte - Faktoren. Bezogen auf den Verlust von Biodiversität gehören dazu insbesondere Einträge von Nähr- und Schadstoffen in Flüsse und Seen über die landwirtschaftliche Nutzung und über Abwässer, klimaaktive Emissionen, aber auch Faktoren wie Bebauung und Nutzung der Landschaft. Die wissenschaftliche Untersuchung, welche Effekte potientielle Umweltschadstoffe auf ganze Ökosysteme haben, ist jedoch ganz und gar nicht einfach. Zum einen schränkt die hoch-dynamische, komplexe Natur von Ökosystemen ihre experimentelle Erforschung und mathematische Modellierung stark ein; es bleibt uns oft nur das Mittel des Umweltmonitorings. Zum anderen jedoch ist die Messung spezifischer Schadstoffe oft so aufwändig und kostspielig, dass es in der Praxis nur selten möglich ist, die Auswirkungen einer breiten Klasse von Schadstoffen in länger laufenden Monitoringprogrammen zu untersuchen.
Der Lösungsansatz: Die Vernetztheit der Organismen in einem Ökosystem ist Segen und Fluch zugleich: Während sie viele Forschungsansätze verkompliziert, schafft sie die Möglichkeit, einzelne Organismen oder Organismengruppen wie Messgeräte für den Gesamtzustand des Ökosystems sowie für andere Ökosystemparameter zu nutzen. Im Rahmen von OTC Genomics werden wir untersuchen, ob und wie wir das Mikrobiom als Indikator für die Belastung der Warnow und der Ostseeküste im Bereich Rostock-Heiligendamm durch verschiedene Herbizide, Pharmazeutika und UV-Filter nutzen können. Die Zusammensetzung des Mikrobiomes wird dabei durch Hochdurchsatz-Sequenzierung der 16s und 18s rRNA-Gene erfasst; die dabei entstehenden riesigen Datenmengen müssen durch hoch-aktuelle Methoden des maschinellen Lernens und des Deep Learnings ausgewertet werden.
Der große Vorteil: Wohingegen frühere Methoden des Monitorings sich oft auf spezifische, morphologisch gut unterscheidbare Mikroorganismen wie Diatomeen und Dinoflagellaten konzentrierten, erlaubt das sequenz-basierte Biomonitoring einen taxonomisch viel diverseren Blick in die Ökosysteme -- und dadurch wahrscheinlich auch viel genauere Abschätzungen der Belastung ebendieser durch anthropogene Einflüsse. Eines der Ziele dieses Forschungsprojektes, ist es, ein hohes Maß an Automatisierung zu erreichen, sodass von der autonomen Probenahme über die Laboraufbearbeitung der Proben bis hin zur visuellen Darstellung der erfassten Daten fast kein manuelles Eingreifen notwendig ist.
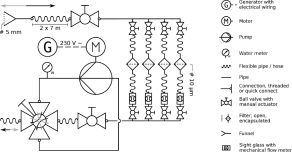
Ein automatischer Durchflussinjektions-Wasserschöpfer
Die Herausforderung: Mikrobielle Gemeinschaften sind die Haupttriebkräfte biogeochemischer Kreisläufe zahlreicher Elemente, die das Leben im Ozean erhalten. Ihre schnelle Reaktion auf Stressfaktoren und abrupte Umweltveränderungen bedeutet, dass selbst schnelle und seltene Ereignisse die lokale Umwandlung von organischen Stoffen und Nährstoffen beeinflussen können. Einer der vielversprechenden Ansätze zur Untersuchung der Funktion mikrobieller Gemeinschaften ist die Analyse der Transkripte in natürlichen mikrobiellen Gemeinschaften (Metatranskriptome). Allerdings können Transkripte in weniger als 30 Sekunden degradiert werden. Ihr unverfälschter Nachweis in der Natur, insbesondere in hypoxischen oder tiefen aquatischen Lebensräumen, ist eine Herausforderung, da sie allein durch die Probenahmeverfahren erheblich verändert werden können. Moderne molekulare Techniken ermöglichen heute die Überwachung der mikrobiellen Aktivitäten und Funktionen in der Umwelt durch die Analyse der Struktur und Funktion natürlicher mikrobieller Gemeinschaften (Charvet et al., 2019).

Der Lösungsansatz: Die erste Generation eines neuen automatischen Fließinjektions-Wasserschöpfers (AFIS) wurde 2012 in unserer Arbeitsgruppe entwickelt (Feike et al. 2012). Dieser AFIS beprobt und fixiert Wasser direkt in der Umgebung und konserviert dadurch sofort das Genexpressionsprofil in-situ. Für eine hochauflösende und standardisierte Überwachung zeitlicher Variationen sind jedoch autonome In-situ-Fixierungsinstrumente unerlässlich. Dieses AFISsys der nächsten Generation wurde im Rahmen des BONUS-Projektes AFISmon entwickelt. AFISsys ist ein zeitprogrammierbarer, autonomer Multi-Wasserprobenehmer. Jeder Prototyp von AFISsys verfügt über mehrere unabhängige, herausnehmbare Probenkammern, die jeweils bis zu 200 ml Wasser sammeln können. Nachdem die Wasserprobe vom Gerät selbständig entnommen worden ist wird in jede Probenkammer automatisch ein ausgewähltes Volumen einer Fixierflüssigkeit injiziert.

Der große Vorteil: AFISsys ist in der Lage, in-situ gesammelte Wasserproben sofort zu fixieren und bis zu einer Woche zu konservieren, bevor sie für eine spätere Analyse im Labor verarbeitet werden. Diese Fähigkeit macht es zu einem einzigartigen Instrument für die Lösung des Problems der unvermeidlichen Verzögerung zwischen der Entnahme der Probe und der Extraktion ihrer Nukleinsäuren (DNA und RNA) und ermöglicht die Untersuchung der Struktur und der Funktionen mikrobieller Gemeinschaften (meta-omics-Analysen) durch eine Verringerung der Verzerrungseffekte durch die Probenverarbeitungsprozesse.



Ein Probenahmegerät für die Mikroplastikbestimmung

Die Herausforderung: Mikroplastik ist in der Umwelt allgegenwärtig, so auch in aquatischen Ökosystemen. Die qualitative und quantitative Bestimmung von Mikroplastik in Gewässern ist allerdings methodisch aufwändig. Zum einen birgt die geringe Größe der Partikel die Gefahr des Probenverlustes, zum anderen sind Kontaminationen der Probe mit Kunstoffen durch die Probenahmegeräte und die Art der Probenverarbeitung zu vermeiden.
Der Lösungsansatz: In der Arbeitsgruppe Umweltmikrobiologie haben wir im Rahmen des BMBF-geförderten Projektes „Microcatch_Balt“ ein mobiles Probenahmegerät für den Feldeinsatz entwickelt, welches die Anforderungen an die Gewinnung kontaminationsfreier quantitativer Mikroplastikproben mit einer unteren Größengrenze von 10 µm unter Verwendung eines gekapselten Durchflussfiltrationskonzepts erfüllt (Lenz et al. 2018).
Der große Vorteil: Das neue Gerätesystem „Rocket“ bietet vor allem zwei Vorteile. Mit den parallel geschalteten Kerzenfiltern in dem geschlossenen System werden alle Partikel, die größer als zehn Mikrometer sind, aufgefangen. Außerdem wurde in dem Gerät, bis auf das relativ seltene PTFE (Polytetrafluoroäthylen), kein Kunststoff verbaut. Damit kann von einer nahezu kontaminationsfreien Beprobung ausgegangen werden.